认知神经工程与AD精准调控团队
团队介绍:
随着全球人口老龄化进程的加剧,以阿尔茨海默病(AD)为代表的神经退行性疾病已成为严峻的社会与健康挑战。这类疾病的病理机制复杂,早期诊断困难,且缺乏有效的干预手段。本团队致力于融合前沿神经影像学、计算科学与神经调控工程,进行认知障碍的“精准诊疗(Theranostics)”。开发并应用多模态磁共振成像技术(sMRI, fMRI, DTI等),结合人工智能与先进的计算模型,挖掘能够在临床症状出现前预警疾病风险的、高维度的生物标记物。同时,我们积极探索以时域干涉(Temporal Interference,TI)为代表的新型无创深部脑刺激技术,旨在通过精确调控病理状态下的深部大脑核团与神经网络,实现对认知功能的修复与重塑。我们的最终目标是建立一个从基础理论(高阶脑网络机制)到关键技术(多模态生物标记物、TI无创神经调控),再到临床应用(AD的早期诊断与干预)的完整研究闭环,为攻克神经退行性疾病提供创新的理论基础和工程解决方案。
研究方向:
1.阿尔茨海默病的多模态磁共振智能诊断与高阶生物标记物挖掘
2.时域干涉(TI)无创深部神经调控的物理机制与临床转化研究
3.大脑结构-功能网络的高阶耦合机制及其在认知障碍中的应用
4.面向精准干预的神经影像-神经调控闭环计算模型构建
科研工作展示:
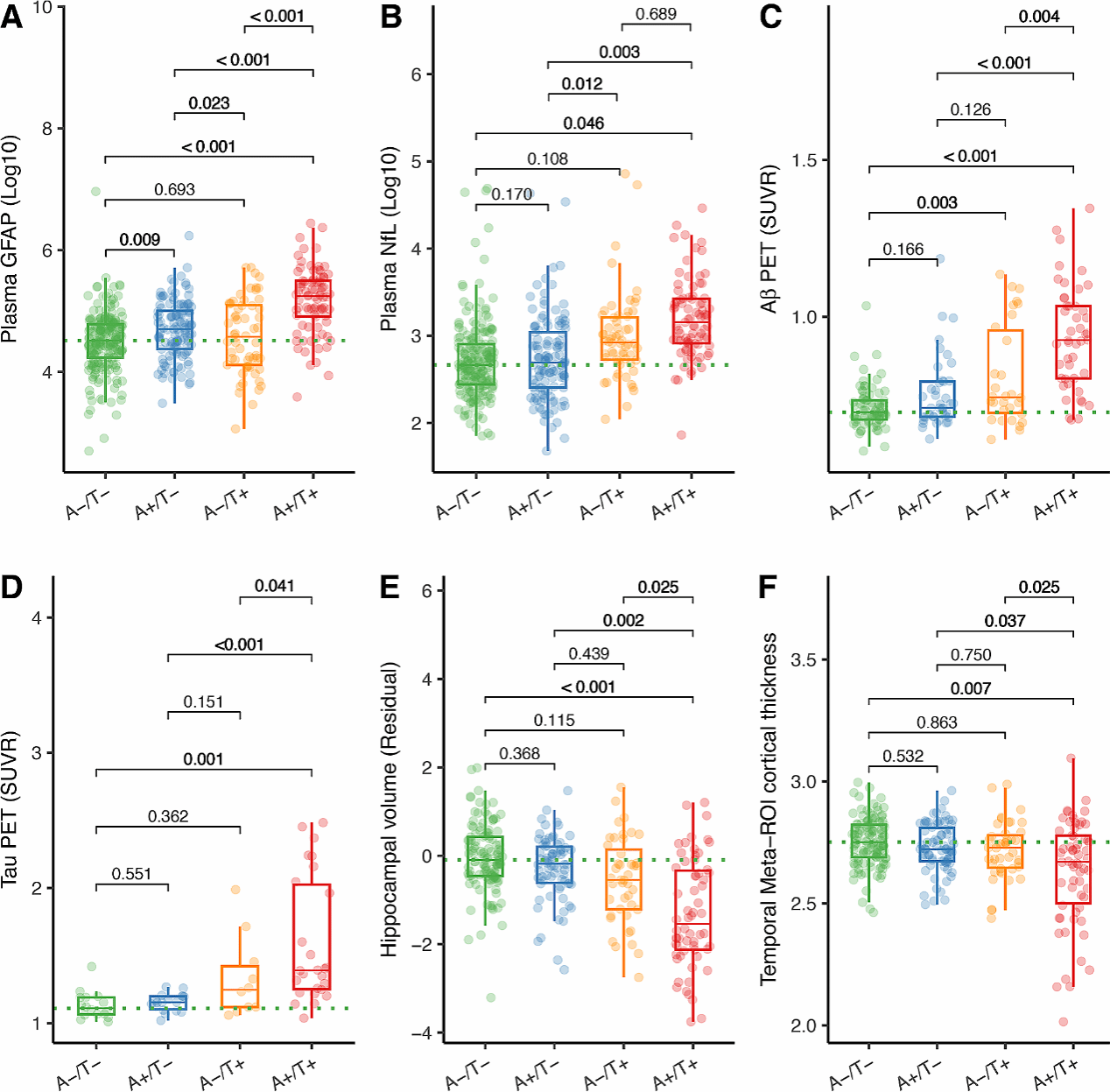
(1)基于血浆多维标志物(Aβ/tau/GFAP)构建预测AD神经退行性速率的计算模型研究
血浆Aβ和p-Tau双阳性(A+/T+)个体的各项AD病理指标最严重。星形胶质细胞反应性(以血浆GFAP衡量)是连接核心病理的关键环节。它不仅与Aβ和p-Tau水平独立相关,更重要的是,它与这两者协同作用,显著加剧了tau蛋白缠结、轴突变性和皮质变薄等神经退行性损伤。该研究证实了血浆标志物在华人AD诊断中的价值,并提供了新证据,表明星形胶质细胞反应性是驱动AD病理从早期Aβ、tau阶段向后期神经退行性变发展的关键加速器,提示靶向抑制星形胶质细胞的过度反应可能是预防AD的重要治疗策略。
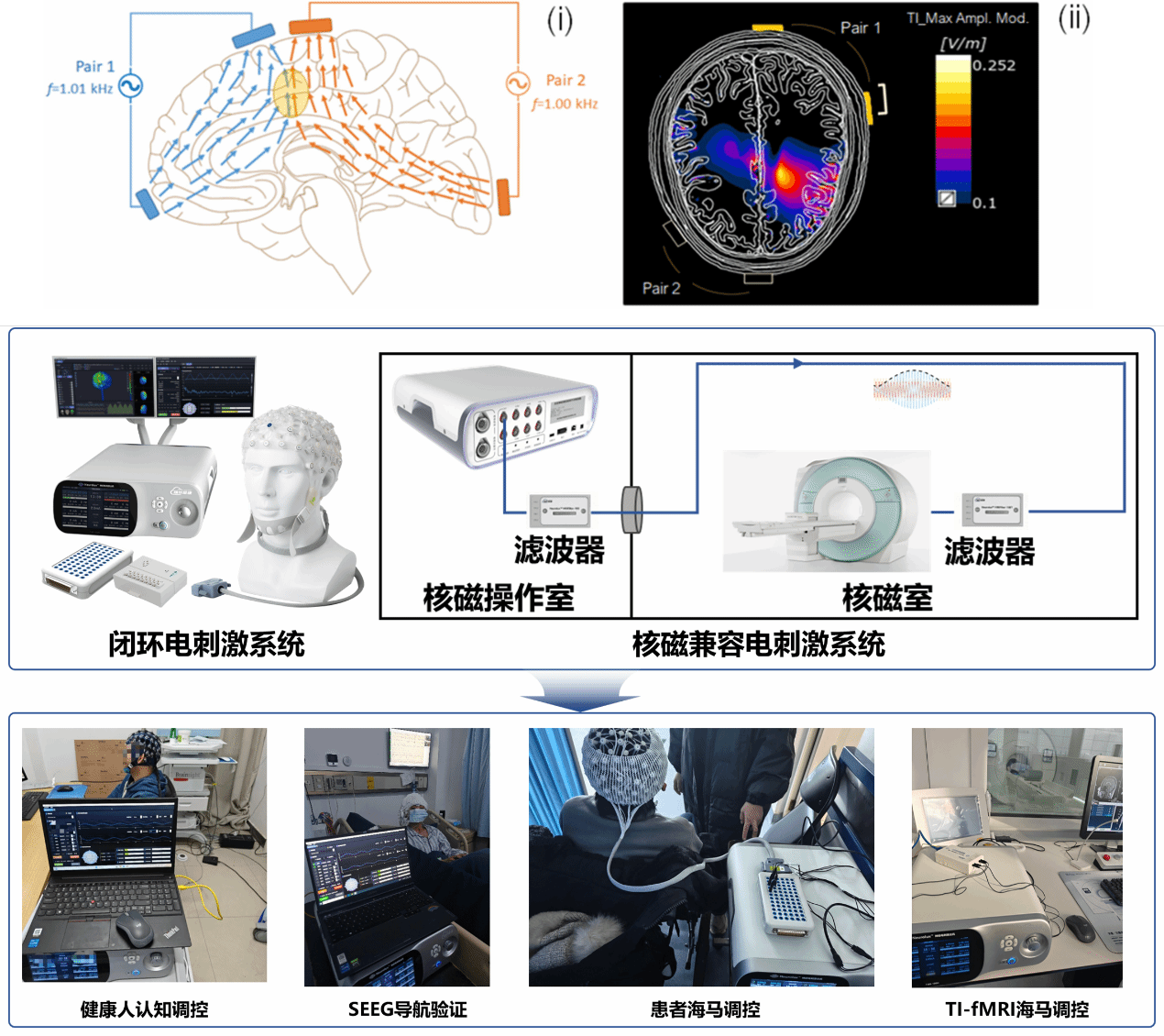
(2)时域干涉(TI)电场聚焦的个体化精准计算与靶点验证
无创深部脑刺激是神经调控领域的重大挑战,传统技术(如TMS, tACS)难以在不影响表层皮质的情况下精准作用于海马体等深部靶点。时域干涉(TI)技术通过施加两个略有差异的高频电场,利用其拍频效应在目标深处产生低频刺激,为这一难题带来了革命性解决方案。本团队以及合作者建立了高精度的、基于个体头部解剖结构(源于MRI数据)的TI电场分布有限元计算模型,能够为特定患者、特定靶点(如海马)优化电极布局和刺激参数。我们正通过临床合作,验证该个体化方案在靶向调控深部神经活动、改善记忆相关环路功能方面的有效性与安全性。